|
卡波姆974p在西咪替丁胃漂浮片的研制
研制西咪替丁胃漂浮片,以便减慢释药、延长药效、减少服药次数。方法以漂浮性、释药性能为指标,对处方和工艺进行单因素考察。结果羟丙甲基纤维素(HPMC
K15M)含量在12.5%左右时,对西咪替丁有缓释作用,卡波姆974p可以阻滞释放,碳酸氢钠对释放速率有影响。HPMCK15M、卡波姆974p及碳酸氢钠均对漂浮性能有影响,而硬度对漂浮性能影响较小。结论制备的西咪替丁胃漂浮片漂浮迟滞时间小于1min,持续漂浮时间大于12h,10h累积释放量达90%,体外释药行为符合Higuchi方程,释药机理为非Fick扩散。
关键词:卡波姆 卡波姆974P 药剂学 胃漂浮缓释片 处方考察 体外释放 西咪替丁
胃内漂浮滞留型缓释片是根据流体动力学(hydro-dynamically balanced
system,HBS)原理制备的一种特殊缓释制剂,口服后能在胃液中漂浮,而不像一般缓释制剂那样沉于胃底。这对一些特殊疾病(如胃溃疡、胃癌及十二指肠疾病等)的治疗有着特殊意义[1]。
西眯替丁(cimetidine)通过竞争性抑制,阻断组织胺对壁细胞H2受体的作用,从而抑制胃酸分泌,对于十二指肠溃疡、胃炎、肠炎等胃肠道疾病有明显的疗效,近年来又发现其有增强免疫、抑制肿瘤增长、抑制病毒等作用[2]。目前,国内外市场上销售的口服剂型有普通片、胶囊剂、缓释片、咀嚼片、口服乳剂等,但由于西眯替丁生物半衰期较短(2.0~3.5h)[3],为保证有效血药浓度,普通片必须多次给药。为减少用药次数,利用其主要在胃内吸收、发挥药效的特性,采用HPMC与卡波姆等辅料制备胃漂浮片,可延长制剂的胃内滞留时间,从而维持一定的血药水平、延长药效、减少服药次数、降低毒副作用、提高生物利用度。
1 材料与方法
1.1 仪器与试剂
单冲式压片机(上海第一制药机械有限公司);PYC2A型片剂硬度仪(上海黄海药检仪器厂);RC一8D型智能药物溶出仪(天津国铭医药设备有限公司);WP2800D2型紫外-可见分光光度计(北京市第二光学仪器厂)。
西眯替丁(无锡市凯利药业有限公司,批号:20040814);羟丙甲基纤维素(HPMC Methocel K15M、K100M由上海卡乐康包衣技术有限公司赠);卡波姆974p(BPGoodrich
Co);碳酸氢钠、CMS-Na、PVP K30、CCMC-Na、MCC等(药用级或分析级)。
1.2 方法
1.2.1 体外释放度测定
西眯替丁在pH=1的盐酸(SA)、pH=3.2的盐酸(SB)及pH=5.8的磷酸盐缓冲液(SC)中的最大吸收波长均为217nm,且各辅料在此波长处无干扰,因此以217nm作为监测波长。用各释放介质分别配制不同浓度的标准溶液,在217nm处测定吸光度,制得标准曲线(见表1)。
Table 1 UV standard curve of cimetidine in different media
Media |
Standard curve
|
Scope/(μg'mL-1)
|
R
|
|
SA
|
A=0.0623 C+0.0371
|
2.968-11.872
|
0.9991
|
|
SB
|
A=0.0608 C+0 0349
|
2.240-12.32
|
0.9992
|
|
SC
|
A=0.0641 C+0.0802
|
2.488-11.196
|
0.9996
|
参照中国药典2005年版附录释放度测定第二法有关规定,取释放介质(除特别说明以外,均为SA)900mL,转速100r·min-1,温度(37±0.5)℃,于不同时间取样5mL,补等量介质,经0.8μm微孔滤膜过滤,适当稀释后,在217nm处测定吸光度A值。依标准曲线计算各时间点的药物累积释放百分率,以药物释放分数对时间作图得药物释放曲线,经拟和得释放方程,计算6h累积释放度Rel和释放50%所用时间T50。
1.2.2 漂浮性观察
在释放度测定时,片剂从投入水中至上浮到水面的时间为漂浮迟滞时间t1,片剂从漂浮到水面至其下沉的时间为持续漂浮时间tf[4]。本文作者考察了HPMCK15M、碳酸氢钠和卡波姆974p的用量对片剂漂浮性的影响。
1.2.3 处方设计及制备工艺的考察
以适量MCC为填充剂,粉末直接压片(除特别说明外,片剂硬度均为7.5kg),分别考察不同规格HPMC、碳酸氢钠及不同混合骨架材料(卡波姆974p、CMS-Na、PVPK30、CCMC-Na)在不同用量下对漂浮性能、释放特性的影响,选出优化处方(见表2)。
Table 2 Formulation of cimetidine floating matrix tablets
Formulations |
F1
|
F2
|
F3
|
F4
|
F5
|
F6
|
F7
|
|
cimetidine/%
|
50
|
50
|
50
|
50
|
50
|
50
|
50
|
|
HPMC K15M/%
|
7.50
|
12.50
|
17.50
|
7.50
|
---
|
17.50
|
12.50
|
|
NaHCO3/%
|
7.50
|
7.50
|
7.50
|
7.50
|
7.50
|
7.50
|
20.00
|
|
Carbopol 974p/%
|
5.00
|
5.00
|
5.00
|
12.50
|
17.50
|
---
|
5.00
|
以优化处方为基础,考察不同制备方法及不同片剂硬度(7.5、11.0、13.5kg)对体外漂浮和药物释放的影响。
1.2.4 体外释放度测定方法的确定
分别以篮法和桨法测定同一批自制漂浮片(F1)释放度时,T50分别为1.6和2.7h,差异显著(见图1)。可见,不同释放度测定方法(桨法和篮法)会影响到测定结果,以下本文所述的体外释放测定方法
除特别指明外均采用桨法。
2 结果
2.1 不同因素对释放度的影响
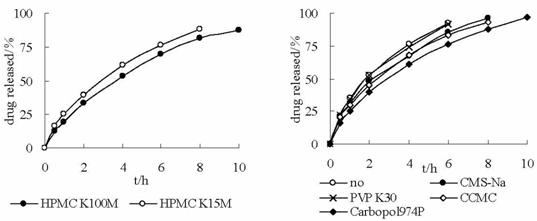
对F1~F7这7个处方在SA中的前10h体外释药行为(见图2)作回归处理,分别用Higuchi或零级释放拟和(见表3)。研究发现,在固定卡波姆974p、碳酸氢钠用量前提下,HPMC粘度增大或用量增加都可以减缓药物释放(见图3),HPMC
K15M用量在12.5%时就可以起到缓释作用;以F2为基础处方考察HPMC
K15M与不同高分子材料混合对漂浮片体外释放的影响(见图4),结果表明,5%的卡波姆974p、羧甲基淀粉钠和交联羧甲基纤维素都有一定的阻滞作用,但卡波姆974p的阻滞效果最好;比较F5和
F6可知,卡波姆974p并不能取代HPMC
K15M单独做骨架材料起到缓释作用;在固定HPMCK15M、卡波姆974p用量前提下,增加碳酸氢钠用量到20%,体外释药减慢呈零级,这是由于虽然碳酸氢钠产生的气泡促进了水化层溶蚀,但另一方面西眯替丁为弱碱性药物,大量的碳酸氢钠碱化了片剂中的释药孔道,导致西眯替丁释放受限制;比较F1和F4可知,在固定HPMC
K15M、碳酸氢钠用量前提下,增加卡波姆974p用量反而加速片剂溶蚀,T50变小,不利于药物缓释。
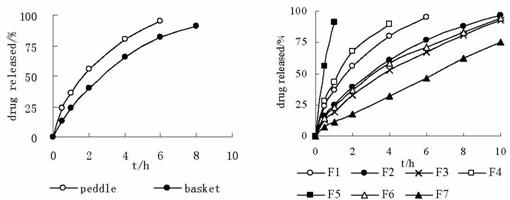
Fig.1 Effect of the measurements on cimetidine release from floating matrix tablets(F1)in vitro
Fig.2 Release profile of cimetidine gastic floating matrix tablets in vitro
Fig.3 Effect of the type of HPMC on cimefidine release from floating matrix tablets(F2) in vitro
Fig.4 Effect of use of blends of matrix-forming polymers on cimefidine release
from floating malrix tablets(F2)in vitro
Table 3 The relationships of fitting release profiles by different equations release
parameters of cimetidine gastric floating matrix tablets(n=6)
Formulations |
Equation
|
r
|
Rel/%
|
T50/h
|
|
F1
|
Qt/Q∞=0.4358t1/2-0.0472
|
0.9969
|
100
|
1.6
|
|
F2
|
Qt/Q∞=0.3377t1/2-0.0787
|
0.9982
|
74.80
|
3.0
|
|
F3
|
Qt/Q∞=0.3172t1/2-0.1294
|
0.9909
|
64.76
|
4.0
|
|
F4
|
Qt/Q∞=0.4813t1/2-0.0441
|
0.9896
|
100
|
1.3
|
|
F5
|
Qt=0.9156t+0.0351
|
0.9827
|
100
|
0.5
|
|
F6
|
Qt/Q∞=0.3283t1/2-0.0903
|
0.9992
|
71.40
|
3.2
|
|
F7
|
Qt=0.0734t+0.0266
|
0.9979
|
46.70
|
6.5
|
依据F3处方,采用湿法制粒压片,压力为7.5
kg时,由Higuchi方程回归得Rel和T50分别为57.9%、4.8h,故湿法制粒压片较粉末直接压片的释药速度慢,这是由于制成颗粒后,减慢了HPMC水化速度;同样是粉末直接压片法,随着片剂硬度的增大,片剂溶蚀较快,加快了药物释放,当硬度较高时还出现突释现象(见图5)。
2.2 不同因素对漂浮性能的影响
F1-F7的体外漂浮实验结果见表4,研究发现,在固定卡波姆974p、碳酸氢钠用量前提下,与HPMC K100M比较,HPMC
K15M能缩短漂浮迟滞时间t1,更有利于片剂的漂浮,这是由于HPMCK15M吸水形成凝胶层,体积膨胀松大,相对于HPMC K100M来说,HPMC K15M的粘度较小,水合速率稍快;随着HPMC
K15M用量增加,在t1减小的同时tf增大,低用量时,片剂溶蚀严重,tf<5h;在固定HPMC
K15M、卡波姆974p用量前提下,增加碳酸氢钠用量可以改善片剂漂浮性,表现在显著缩短t1同时延长tf;在固定HPMC
K15M、碳酸氢钠用量前提下,增加卡波姆974p用量,片剂则悬浮于供试液中,片剂漂浮性下降;采用湿法制粒并增大片剂硬度,会影响到片剂的漂浮性,但并不显著,随着片剂硬度的增大,漂浮迟滞时间延长,持续漂浮时间缩短。
综合释放度和漂浮性考察结果,认为F3为最佳处方,而以粉末直接压片法制备漂浮片,硬度控制在(7.5±0.5)kg为最佳工艺。
Table 4 Floating abilities of various formulations(n=6)
Formulations |
t1/min
|
|
tf/h
|
|
F1
|
|
30~35
|
|
5
|
|
F2
|
HPMC K15M
|
5~10
|
|
10
|
|
|
HPMC K100M
|
8~12
|
|
10
|
|
F3
|
7.5kg
|
10~20①
|
|
12
|
|
|
11kg
|
2~3
|
|
10
|
|
|
13.5kg
|
8~10
|
|
8
|
|
|
wetgranulated
|
2~4
|
|
8
|
|
F4
|
|
1~2
|
|
suspended
|
|
F5
|
|
|
without floating
|
|
|
F6
|
|
30~60①
|
|
>10h
|
|
F7
|
|
10~20①
|
|
>10h
|
- was expressed second
2.3 胃漂浮片体外释药机理
不同个体以及同一个体在饭后和禁食状态下胃液的pH值有较大差异,且西眯替丁为抑酸药,因此在不同的pH环境下,保持近似相同的释药量可以减少用药的个体差异,提高药物的生物利用度。西眯替丁胃漂浮缓释片(F3)在SA、SB和SC三种释放介质中的体外释放曲线见图6。以Peppas方法拟合[5,6],三条释放曲线的n值分别为0.675、0.7251、0.8336(相关系数r分别为0.9992、0.9729、0.9990),0.45<n<0.89,说明本制剂的体外药物释放为非Fick扩散,即扩散和骨架溶蚀协同作用。
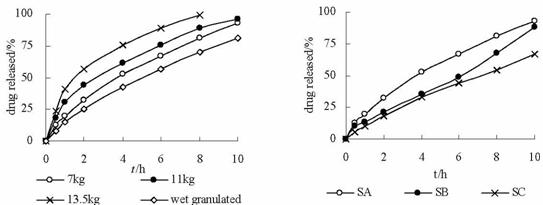
Fig.5 Effect of the preparing method of
matrix Fig.6 Release profile of cimetidine
gastric floating
tablets on cimetidine release release from
floating
matrix tablets in vitro in different release media
matrix tablets(F3)in vitro
3 讨论
漂浮制剂的初始浮力和持续浮力是决定其能否实现胃内漂浮滞留的关键。本课题组研制的西咪替丁胃漂浮缓释片漂浮迟滞时间小于1min,持续漂浮时间大于12h,显示了良好的体外漂浮特性,在体外释放过程中,10h累积释放量达90%,释药过程中制剂完整性保持良好。
胃漂浮缓释片中药物的释放是一个复杂的过程,包括水渗入骨架、骨架材料形成凝胶、已溶解的药物在生成的凝胶层中的扩散和凝胶骨架的溶蚀。本制剂体外释放曲线以Peppas方法拟和,0.45<n<0.89,说明本制剂药物体外释放机理为扩散和骨架溶蚀协同作用。
片剂的体外释放测定通常采用转篮法。本文通过对转篮法和桨法所测结果的比较表明,转篮法测定中片剂释药明显慢于桨法。这是由胃漂浮缓释片的漂浮性及其骨架材料水化后的粘附性和膨胀性决定的,采用转篮法时,片剂膨胀并粘附在转篮底部或侧壁,从而阻碍了片剂表面的释药,因此本文采用桨法测定。这与文献[7]的报道一致。
实验中曾将F3处方经湿法制粒,结果颗粒较硬,制得的片剂孔隙率较小,透水性较差,延缓了HPMC的水化程度,降低了释药速率。本文的研究表明,干粉直接压片制得的片剂释药明显快于采用湿法制粒压片制得的片剂。这与文献[4,7]的报道一致。
本文对不同规格HPMC制备片剂的比较表明,HPMC规格对西咪替丁胃漂浮缓释片的释药有影响,以HPMC
K15M为骨架材料的片剂释药略快。释药速率的差异可能是由于不同规格HPMC的水化速度及水凝胶骨架致密程度的差异所造成的。这与文献[8,9]的报道不同。参考文献:
[1] Thanoo BC, Sunny MC, Jayakrishnan A. Oral sustained release drug delivery systems using
polycar-bonate microsphere capable of floating on the gastric fluid[J]. J Pharm Pharmacol, 1993, 45(1):
21-24.
[2] 金舟野,陈浩宏.西咪替丁临床应用研究进展[J].医学综述,2000,6(9):424-425.
[3] Mirjam C. Gerber, Gopi A. Tejwani, et al. Drug interactions with cimetidine: an update[J]. Pharm
Ther, 1985, 27(3):353-370.
[4] LU Yao-ru, ZHANG Jun-shou, YANG Min, et al. Preparation of domperidone sustained relea se floating
tablets [J].J.China Pharma Univ (中国药科大学学报), 2003, 34(4): 327-329.
[5] Korsmeyer RW, Gurny R, Doelker E, et al. Mechanism of solute release from porous hydrophilic
polymers [J] .Int J Pharm, 1983,28(1): 25-35.
[6] Ritger PL, Peppas NA. A simple equution for description of solute release. Ⅱ. Fickian and
anomalous
expression from swellable devices [J]. J Control Release, 1987, 5(1): 37-42.
[7] Streubel A, Siepmann J, Bodmeier R. Floating matrix tablets based on low density foam powder:
effects of formulation and processing parameters on drug release [J]. Eur J Pharm Sci, 2003, 18(1): 37-45.
[8] XU Qun-wei, HAO Qing, ZHU Xiang-jun. Study on HPMC matrix tablet s of metformin hydrochloride [J].
J China Pharma Univ (中国药科大学学报), 2000, 31(1):15-17.
[9] Xu GJ, Sunada H. Influence of formulation change on drug release kinetics form
hydropropyl-methylcellulose matrix tablets [J]. Chem Pharm Bull, 1995, 43(3): 483.
Preparation and in vitro release of cimetidine intra-gastric floating sustained release tablets GONG
Jing, Zhuang Dian-you, SHANG De-wei, SU De-sen, WANG Si-ling
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
Abstract: Objective To develop the cimetidine gastric floating controlled drug delivery systems, which can
prolong gastric residence time, extend release, and reduce administration times. Methods The floating
behavior and the in vitro release characteristics of cimetidine was used as the screening indexes. A
single-factor study was also employed to optimize formulation. Results When the content of HPMC K15M was
about 12.5%, the release rate of cimetidine was obviously sustained, Carbopol 974p could slower the release,
and sodium bicarbonate also had an effect on the release profile. HPMC K 15M, Carbopol 974 p and sodium
bicarbonate could affect the floating properties of tablets while hardness had little effect on them.
Conclusion Floating lag time of cimetidine intra-gastric floating sustained release tablets is less than 1
min, duration of floating is more than 12 h, and the tables has total drug release in10 h is more 90
percent,
and the in vitro release of cimetidine fits Higuchi equation well. Key words: pharmaceutics; floating
tablets; formulation; in vitro dissolution; cimetidine
|